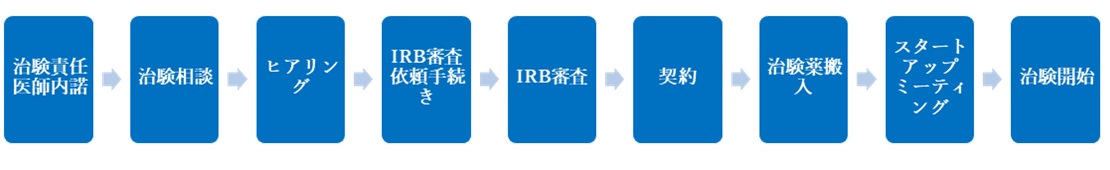
治験実施の手続き
治験標準業務手順書
治験審査委員会手順書
治験書式
当院は統一書式を使用しています。
契約書一覧
- 1. 治験契約書2者(医薬品) (DOC ファイル 0.05MB)
- 2. 治験契約書2者(医療機器) (DOC ファイル 0.05MB)
- 3. 治験契約書2者(再生医療等製品) (DOC ファイル 0.05MB)
- 4. 治験契約書3者(医薬品) (DOC ファイル 0.05MB)
- 5. 治験契約書3者(医療機器) (DOC ファイル 0.05MB)
- 6. 治験契約書3者(再生医療等製品) (DOC ファイル 0.05MB)
- 7. 製販後契約書2者(医薬品) (DOC ファイル 0.06MB)
- 8. 製販後契約書2者(医療機器) (DOC ファイル 0.06MB)
- 9. 製販後契約書2者(再生医療等製品) (DOC ファイル 0.06MB)
- 10. 製販後契約書3者(医薬品) (DOC ファイル 0.06MB)
- 11. 製販後契約書3者(医療機器) (DOC ファイル 0.06MB)
- 12. 治験覚書2者(医薬品) (DOC ファイル 0.03MB)
- 13. 治験覚書2者(医療機器) (DOC ファイル 0.03MB)
- 14. 治験覚書2者(再生医療等製品) (DOC ファイル 0.03MB)
- 15. 治験覚書3者(医薬品) (DOC ファイル 0.04MB)
- 16. 治験覚書3者(医療機器) (DOC ファイル 0.03MB)
- 17. 治験覚書3者(再生医療等製品) (DOC ファイル 0.03MB)
- 18. 製販後契約書3者(再生医療等製品) (DOC ファイル 0.06MB)
- 19. 製販後覚書2者(医薬品) (DOC ファイル 0.04MB)
- 20. 製販後覚書2者(医療機器) (DOC ファイル 0.03MB)
- 21. 製販後覚書2者(再生医療等製品) (DOC ファイル 0.03MB)
- 22. 製販後覚書3者(医薬品) (DOC ファイル 0.04MB)
- 23. 製販後覚書3者(医療機器) (DOC ファイル 0.03MB)
- 24. 製販後覚書3者(再生医療等製品) (DOC ファイル 0.03MB)
(3)ヒアリング:IRB4週間前くらいまで
- 治験依頼者より治験の概要説明をお願い致します。
- プロジェクター等の準備が必要な場合は事前にお知らせください。
- ヒアリング参加者は、CRC・臨床研究事務局の6名程度となります。
- ヒアリング開催日3週間前までに下記の資料(6部)を送付してください。
- ヒアリング開催前に、確認事項について連絡致しますので、ヒアリング時にご回答をお願い致します。
事前提出書類
- 治験実施計画書
- 治験薬概要書
- 同意説明文書
- 治験参加カード見本
- 症例報告書見本
(4)IRB審査手続き
【初回】
治験責任医師が出席し、治験説明をします。
IRB審議資料(20部)を3週間前までに提出ください。 審議終了後着払いにて返却させていただきます。
【2回目以降】
IRB審議・報告資料(各20部)を2週間前までに提出ください。
治験責任医師が出席し、治験説明をします。
IRB審議資料(20部)を3週間前までに提出ください。 審議終了後着払いにて返却させていただきます。
【2回目以降】
IRB審議・報告資料(各20部)を2週間前までに提出ください。
(5)IRB審査
(6)契約
- 契約書のドラフト版を(rinshokenkyu@chutoen-hp.shizuoka.jp)宛てにメールにてご提出ください。
- 院内確認終了後、ご連絡いたします。原本作成(押印・日付空欄)後、速やかに提出してください。
※契約書作成時の注意事項
契約機関名 :掛川市・袋井市病院企業団
契約者 :掛川市・袋井市病院企業団 企業長 宮地正彦
治験責任医師:掛川市・袋井市病院企業団立中東遠総合医療センター
(例)●●科 中東遠花子
(7)治験薬搬入・回収
- 治験薬管理者 :中山貴美子
- 治験薬管理補助者:伊藤政治 田辺由紀子 北島信三 浅井澄子
- 治験薬搬入は、契約締結後にお願い致します。
- 治験薬搬入・回収日時は、事前にご相談ください。(第三者による搬入可)
(8)スタートアップミーティング
- 治験責任医師・分担医師・担当部署(診療技術部門、薬剤部、看護部等)・CRC・治験事務局が参加します。事前に担当CRCへ参加人数を確認のうえ資料の準備をお願いいたします。
- 会場、プロジェクター等の準備について日程調整を含め担当CRCと相談してください。
- スタートアップミーティング前までに、症例ファイルのご準備をお願いいたします。
(9)治験開始後
①直接閲覧の手続き
②各種変更手続き
下記書類を臨床研究管理室へ提出してください。
【必要書類】
(A)変更箇所一覧
(B)変更契約書(案)変更覚書(案)
(C)その他(変更内容に応じて)
※ 医師の所属変更については、こちらで対応します。
③継続審査
(A)治験実施状況報告書(統一書式11)
- 実施希望日2週間前までに、希望日時を(rinshokenkyu@chutoen-hp.shizuoka.jp)宛てにメールでご相談ください。
- 日時が決まり次第、直接閲覧実施連絡票と該当治験のモニタリング担当者であることを示す資料を(rinshokenkyu@chutoen-hp.shizuoka.jp)宛てにメールでご提出ください。
- 電子カルテ閲覧用ID取得申請は、プロトコール単位でなく個人で行いますので、カルテ閲覧される方全員の氏名をご連絡ください。
- 該当治験のモニタリング担当者であることを示す資料の提示をお願いいたします。
②各種変更手続き
下記書類を臨床研究管理室へ提出してください。
【必要書類】
(A)変更箇所一覧
(B)変更契約書(案)変更覚書(案)
(C)その他(変更内容に応じて)
※ 医師の所属変更については、こちらで対応します。
③継続審査
- 治験期間が1年を越える場合は、少なくとも1年に1回の頻度で継続審査を行います。
- 治験契約締結月を起点として、1年を越えない直近のIRBで審議をします。
(A)治験実施状況報告書(統一書式11)
(10)治験終了(中止・中断)
- 症例報告書が固定後、速やかに終了報告書を提出してください。
- 終了後の確認事項対応等は可能です。
【必要書類】
(A)治験終了(中止・中断)報告書(統一書式17)
(A)治験終了(中止・中断)報告書(統一書式17)
PDFファイルをご覧になるためには、AdobeReader® が必要です。パソコンにインストールされていない方は右のアイコンをクリックしてダウンロードしてください。


